 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène singulet et la vie: partie C - Production contrôlée de l'oxygène singulet et ses applications médicales
C Deby
 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène singulet et la vie: partie C - Production contrôlée de l'oxygène singulet et ses applications médicales
C Deby
C.1. Thérapie photodynamique (PDT) des tumeurs malignes
Le terme "photodynamique" remonte à une publication centenaire de von Tappeiner et al (1904), intitulée "de l'effet de substances photodynamiques (fluorescentes) sur les Protozoaires et les enzymes".
von Tappeiner H, Jodlbauer A. Über die Wirkung der photodynamischen (fluorescierenden) Stoffe auf Protozoen und Enzyme. Deutsches Arch Klin Med. 1904; 39: 427-87.
On pourrait dire "thérapie photochimique ". L'expression "photodynamique" est maintenant généralisée: PDT. Les substances photodynamiques utilisées en PDT sont souvent désignées par PhS (de "photosensibilisateur").
C.1.1. Bases
a. Observation faite en 1960 que les tumeurs malignes concentrent les hématoporphyrines qui les rendent fluorescentes1.
b. L'irradiation par un rayonnement situé dans le rouge (640-850 nanomètres) produit de l'oxygène singulet selon le mécanisme décrit plus haut (A.3.1)2.
c. La courte durée d'existence de 1Δg ne lui permet qu'un très court rayon d'action in vivo (<20 nanomètres), ce qui limite strictement l'étendue des destructions aux zones irradiées, sans extension dommageable3.
Le premier PhS à avoir été utilisé cliniquement a été le Photofrin, un mélange d'oligomères contenant plus de 8 porphyrines et unis par des liaisons esters et éthers. Ce produit est injecté par voie intraveineuse. L'irradiation de la région à traiter a lieu 40 à 50 heures plus tard. Généralement on emploie un rayonnement laser (630 nm).
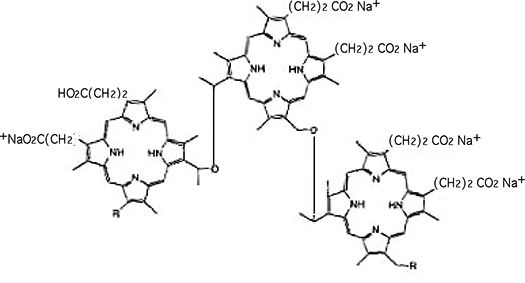
Fig. 42 : L'un des premiers photosensibilisateurs utilisés en PDT : le Photofrin.
C.1.2. Lieux intracellulaires préférentiels
Il faut que les photosensibilisateurs pénètrent dans les cellules pour être efficaces2.
Le Photofrin décrit ci-dessus localise les photolésions dans les mitochondries4,5. Les porphyrines monocationiques se concentrent dans les membranes6 et la lysyl chlorine p6 dans les lysosomes7, propriété importante car une libération d'hydrolases destructrices se produit dans la cellule atteinte.
Les PhS lipophiles sont plus actifs que les hydrophiles, car ils se localisent dans les membranes, ce qui fragilise plus efficacement la cellule-cible8.
Fait important, la plupart des photosensibilisateurs utilisés en PDT ne pénètrent pas dans les noyaux et affectent peu le DNA, ce qui diminue nettement les risques de mutation et de cancérisation au cours de cette thérapie9.
C.1.3. Généralités photochimiques
A l'inverse des photothérapies UV (tel le traitement du psoriasis), la PDT utilise une lumière rouge comprise entre 600 et 700 nanomètres; il s'agit souvent de faisceaux laser. De plus, elle exige un traitement préparatoire par un photosensibilisateur dont l'application est de durée variant selon la nature du PhS (de quelques heures à quelques jours, selon la nature chimique de cet agent). Un troisième facteur est indispensable : l'oxygène. Ni le rayonnement, ni les PhS ne sont nuisibles par eux-mêmes.
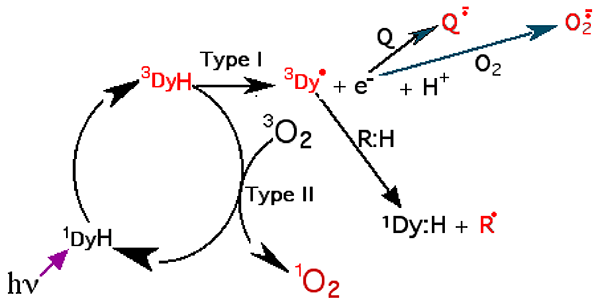
Fig. 43 : Schéma général de la PDT. On reconnaît l'utilisation du schéma de la fig. 5 (voir partie A.3).
Le photosensibilisateur est symbolisé par DyH. Q = quinone. En rouge : les formes excitées.
La fig. 43 résume les 2 types de réactions mises en jeu dans la PDT. Dans une première étape, le rayonnement hν (600-800 nm) excite le 1DyH (photosensibilisateur) qui, de singulet, passe à l'état de triplet, 3DyH. A partir de ce stade, il y a 2 possibilités :
a) Réactions de Type I : le donneur DyH perd un proton et un électron en devenant un radical libre neutre.
3Dy : H → 3Dy• + H+ + e- (XXIII)
Ces réactions exigent le voisinage immédiat d'une molécule acceptrice d'électron qui peut être
- soit un composé électrophile comme une quinone Q qui devient une semi-quinone, radical anionique,
- soit une molécule d'O2 triplet qui devient anion superoxyde.
Le radical 3Dy• arrache un atome d'hydrogène à une molécule organique R : H, régénérant le photosensibilisateur singulet 1DyH, mais créant un nouveau radical R• qui, en présence d'oxygène fondamental, donnera une série de réactions en chaîne : peroxyl, hydroperoxyde, alkoxyl, etc…
b) Réactions de Type II (voir le commentaire de la fig. 5, partie A.3.) : la molécule excitée DyH transfère son excès d'énergie à une molécule d'oxygène 3O2 qui devient singulet, tandis que se reforme le photosensibilisateur primitif.
C.1.4. Qualités d'un photosensibilisateur utilisable en PDT
Le PhotofrinR fut le premier PhS d'emploi autorisé pour le traitement de diverses tumeurs accessibles à une irradiation : œsophage, vessie, col utérin, estomac.
Puis vint une seconde génération de PhS de nature chimique plus précise, plus purifiés, absorbant des radiations lumineuses de plus grande longueur d'onde.
Les qualités exigées sont :
a) présenter un coefficient d'absorption élevé dans la région spectrale occupée par la lumière d'excitation,
b) avoir, à l'état triplet, une énergie suffisante pour exciter l'oxygène fondamental (>95kJ/môle),
c) avoir une durée de vie suffisamment longue à l'état triplet (>1ms),
d) être très photostable (non décomposé par la lumière).
Parmi les diverses molécules essayées en PDT, ce sont les tétrapyrroles, dont les porphyrines et surtout les phtalocyanines (Partie A, fig. 10), qui ont été retenues, les dernières ayant une forte absorption dans le rouge, zone du spectre pénétrant le mieux dans le tissus10. Ces molécules sont généralement utilisées sous forme de complexes métalliques (Zn, Al).
Tout récemment, le bleu de méthylène a été proposé comme PhS pour le traitement des plaques résistantes de psoriasis11.
Quatre articles sont parus en 2005 et en 2008 sur ce sujet et leur lecture est recommandée au lecteur intéressé12,13,14,17.
C.2. Sélectivité des cibles
Nous avons vu qu'une particularité de la photogénération de l'oxygène singulet est que cet agent n'agit qu'à une extrême proximité de la molécule de photosensibilisateur, car sa diffusion est limitée par sa brièveté d'existence. On estime que son rayon d'action ne peut dépasser, en milieu biologique, 45 nanomètres (0,045 microns)15. On voit l'importance à accorder à la distribution du photosensibilisateur. C'est sa localisation qui détermine le lieu où agira l'oxygène singulet.
Certaines porphyrines se localisent rapidement dans les tumeurs et permettent l'irradiation 3 heures après leur administration intraveineuse. De nouveaux composés sont à l'étude, tels les dérivés de la phtalocyanine (Partie A, fig. 10), tétrapyrroles capables de chélater un métal (Al, Zn, Cu, Fe, Ni).
C.3. Dosimétrie de 1Δg
Ces mesures sont difficiles. Nous avons vu dans la partie A (A.4.2.) que l'intensité de la luminescence spécifique de l'oxygène singulet (1270 nm) est très faible. Néanmoins, des détecteurs de plus en plus sensibles ont été réalisés (B.1.1). De plus, il est évident que l'oxygène singulet se forme de manière continue durant la durée du rayonnement excitateur et en quantité bien plus importante que dans les phénomènes biologiques naturels.
C'est en perfectionnant considérablement l'appareillage de détection de lumière que Niedre et al.16 ont été capables de mesurer la très faible fraction d'oxygène singulet décroissant selon la réaction
1Δg → 3O2 + hν (1270 nm)
et d'appliquer leur technique in vivo17. Le perfectionnemment de l'appareillage consistait en l'usage d'un photomultiplicateur sensible uniquement dans le proche infra-rouge.
C.4. Mécanisme de la mort cellulaire par PDT
Deux processus sont classiquement invoqués2:
a) Effet direct sur les cellules tumorales qui meurent en apoptose.
Ce processus est dominant lorsque le PhS s'accumule dans les mitochondries, lieu où démarre la cascade apoptotique.
b) Ralentissement du flux sanguin par vasoconstriction ou lésion vasculaire, ce qui doit amener la nécrose du tissu irradié.
Pour le premier point, peu contestable, le lecteur est prié de se référer au magnifique travail de synthèse réalisé par Almeida et al., en 2004 pour décrire les mécanismes apoptotiques déclenchés par la PDT18.
Quant à la deuxième assertion, elle est en contradiction avec le fait évident que la production d'oxygène singulet dépend d'un apport suffisant d'oxygène fondamental, donc d'une vascularisation suffisante. L'obligation d'une bonne disponibilité de l'oxygène triplet est soulignée par le travail récent de Sterenborg et al.19 Cependant, une fermeture complète des vaisseaux irrigant une tumeur peut être décisive pour la disparition de celle-ci20.
Deux voies principales d'apoptose sont proposées18 :
a) extrinsèque : ce sont les récepteurs cellulaires de surface au TNF-α et analogues, qui sont stimulés et activent la voie de la caspase-8
b) intrinsèque : attaque directe des fonctions mitochondriales, avec libération du cytochrome C dans le cytosol qui forme avec l'Apaf-1 un complexe, l'apoptosome, activateur de la caspase-9.
C.5. Bibliographie
1. Dougherty TJ, Marcus SL. Photodynamic therapy. Eur J Cancer 1992; 28A(10): 1734-42. Review.
2. Dougherty TJ, Gomer CJ, Henderson BW, Jori G, Kessel D, Korbelik M, Moan J, Peng Q. Photodynamic therapy. J Natl Cancer Inst. 1998; 90: 889-905. Review.
3. Moan J, Berg K. The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochem Photobiol. 1991; 53: 549-53.
4. Salet C, Moreno G, Bazin M, Santus R. Oxic and anoxic photodamage triggered at the subcellular level by the synergistic action of haematoporphyrin derivative and nitroimidazoles. Int J Radiat Biol Relat Stud Phys Chem Med. 1986; 50: 295-303.
5. Murant RS, Gibson SL, Hilf R. Photosensitizing effects of Photofrin II on the site-selected mitochondrial enzymes adenylate kinase and monoamine oxidase. Cancer Res. 1987; 47: 4323-8.
6. Kessel D, Woodburn K, Henderson BW, Chang CK. Sites of photodamage in vivo and in vitro by a cationic porphyrin. Photochem Photobiol. 1995; 62: 875-81.
7. Kessel D, Woodburn K, Gomer CJ, Jagerovic N, Smith KM. Photosensitization with derivatives of chlorin p6. J Photochem Photobiol B. 1995; 28: 13-8.
8. Moan J, Peng Q, Evensen JF, Berg K, Western A, Rimington C. Photosensitizing efficiencies, tumor- and cellular uptake of different photosensitizing drugs relevant for photodynamic therapy of cancer. Photochem Photobiol. 1987; 46: 713-21.
9. Moan J. Porphyrin photosensitization and phototherapy. Photochem Photobiol. 1986; 43: 681–90.
10. DeRosa MC, Crutchley RJ. Photosensitized singlet oxygen and its applications. Dermatol. 2002; 8: 42-9.
12. Morton CA, McKenna KE , Rhode LE. Guidelines for topical photodynamic therapy : update. Brit J Dermatology 2008; 159: 1245-66.
13. Josefsen LB, Boyle RW. Photodynamic therapy and the development of metal-based photosesitizers. Met Based Drugs 2008; 2008: 276109.
14. Tandon YK, Yang MF, Baron FD. Role of photodynamic therapy in psoriasis: a brief review. Photodermatol Photoimmunol Photomed. 2008; 24: 222-30.
15. a) Latch DE, McNeill K. Microheterogeneity of singlet oxygen distributions in irradiated humic Acid Solutions Science 2006: 311: 1743-47.
b) Hatz S, Poulsen L, Ogilby PR. Time-resolved singlet oxygen phosphorescence measurements from photosensitized experiments in single cells: Effects of oxygen diffusion and oxygen concentration. Photochem Photobiol. 2008; 84: 1284-90.
c) Zebger I, Snyder JW, Andersen LK, Poulsen L, Gao Z, Lambert JD, Kristiansen U, Ogilby PR. Direct optical detection of singlet oxygen from a single cell. Photochem Photobiol. 2004; 79(4): 319-22.
16. Niedre M, Patterson MS, Wilson BC. Direct near-infrared luminescence detection of singlet oxygen generated by photodynamic therapy in cells in vitro and tissues in vivo. Photochem Photobiol. 2002; 75(4): 382-91.
17. Niedre MJ, Yu CS, Patterson MS, Wilson BC. Singlet oxygen luminescence as an in vivo photodynamic therapy dose metric: validation in normal mouse skin with topical amino-levulinic acid. Br J Cancer 2005; 92(2): 298-304.
18. Almeida RD, Manadas BJ, Carvalho AP, Duarte CB. Intracellular signaling mechanisms in photodynamic therapy. Biochim Biophys Acta 2004; 1704(2): 59-86.
19. Sterenborg H, de Wolf J, Koning M, Kruijt B, van den Heuvel A, Robinson D. Phosphorescence-Fluorescence ratio imaging for monitoring the oxygen status during photodynamic therapy. Opt Express. 2004; 12(9): 1873-8.
20. Henderson BW, Dougherty TJ. How does photodynamic therapy work? Photochem Photobiol. 1992; 55(1): 145-57. Review.